A COLETA
A identificação precisa de um fitonematóide depende, primariamente, das amostras de solo e raízes que chegam ao laboratório. Portanto essas amostras devem merecer atenção especial, devendo ser coletadas corretamente enviadas para exame no laboratório o mais breve possível.
O QUE COLETAR
Solo e raízes devem ser coletados, sempre que possível. O solo a ser coletado deve ser proveniente da rizosfera. No caso de raízes, para a maioria dos casos, recomenda-se coletar preferencialmente as radicelas, pois fitonematóides tem preferência por parasitar raízes mais finas. As raízes coletadas devem estar vivas. Desta forma poderão ser recuperados mais facilmente os nematóides ainda vivos. Pois, para determinados grupos de nematóides, como os formadores de galhas Meloidogyne, existe a necessidade de obtenção de exemplares ainda vivo para a identificação da espécie.
Deve-se coletar amostras de solo com umidade natural, evitando-se condições de encharcamento ou ressecamento. Não se deve adicionar água ao solo naturalmente seco, para facilitar a coleta, nem depois, ao solo já coletado, pode acontecer a proliferação de microrganismos que prejudica a conservação da amostra.
QUANTO COLETAR
A quantidade de material em cada amostra coletada deve ser de 1kg de solo e pelo menos 200g de raízes finas (radicelas). Para coletar as raízes, recomenda-se retirar uma ou duas plantas inteiras em cada ponto de amostragem.

QUANDO COLETAR
A época de florescimento da cultura é a ideal para realizar a análise de nematoide. Porque as amostragens realizadas na entressafra normalmente apresentam não representa o nível populacional causador da perda na área.

ONDE E COMO COLETAR
Nas manchas (reboleiras) onde as plantas não estão desenvolvendo bem (levando em consideração as condições de clima, fertilidade de solo, entre outras).
Em cada ponto de coleta, as amostras de solo e raízes devem ser retiradas da camada de 0 cm a 30 cm ou 0 cm a 30 cm de profundidade. As subamostras de solo e raízes podem ser obtidas com uso de enxadões, enxadas, pás retas e trados-de-solo.

Durante a amostragem, deve-se caminhar em zigue zague no local. Coletar amostras junto às plantas com sintomas moderados evitando-se aquelas muito atacada, amostrar as plantas da bordadura da mancha.
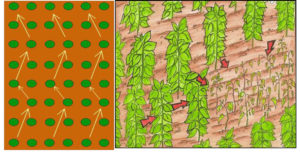
Cada amostra composta deve ser formada por subamostras (de solo e raízes) coletadas em áreas semelhantes. As amostras devem ser colocadas em um balde grande e homogeneizadas para constituir uma amostra composta representativa da área. Recomenda-se coletar no mínimo 10 subamostras por hectare para formar uma amostra composta. Se a área for muito grande, recomenda-se dividi-la em quadrantes de 10 hectares no máximo, selecionar pelo menos 5 a 10 quadrantes e retirar uma amostra composta de cada quadrante selecionado. O responsável pela coleta deve ter bom senso para a definição do número de subamostras e amostra que irá representar a área. Quanto maior o número de subamostras e amostras, mais precisos e confiáveis será o resultado da análise.
ACONDICIONAMENTO, IDENTIFICAÇÃO E TRANSPORTE DAS AMOSTRAS
As subamostras de solo e de raízes deverão ser bem homogeneizadas em um balde e acondicionadas juntas em saco plástico e identificados.
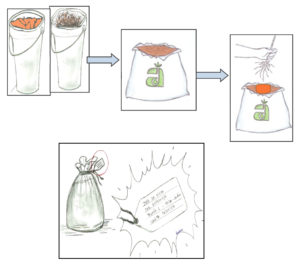
Após a coleta, as amostras deverão permanecer em ambiente fresco e ventilado. As amostras devem ser encaminhadas ao laboratório o mais breve possível. Embaladas adequadamente podem ser mantidas em geladeira por no máximo 5. Caixas de isopor são indicadas para o acondicionamento de amostras durante o transporte ao laboratório.
Fonte: NEMATÓIDES UM DESAFIO CONSTANTE
Dra. Neucimara Rodrigues Ribeiro – Associação dos Produtores de Sementes de Mato Grosso (APROSMAT)
Dra. Luciany Favoreto – Epamig/Uberaba
Dra. Denise Mesa Miranda – APROSMAT
Ilustrações: Luciana Marques









